Startseite > Naturwissenschaften > Allgemeine und anorganische Chemie
![]() Michael Neuhold Homepage
Michael Neuhold Homepage
Startseite >
Naturwissenschaften >
Allgemeine und anorganische Chemie
Ich habe ein Semester lang an der Krankenpflegeschule Chemie unterrichtet. Dabei ging es um grundlegende Dinge auf dem Niveau der Unterstufe: Atommodell, chemische Bindung, Säuren und Laugen, pH-Wert, Radioaktivität. Nicht alle Details des Stoffes sind mir selber klar geworden. Meine hauptsächlichen Quellen für diese Seite:
Ein Beispiel: Kochsalz in Wasser aufgelöst ist ein Gemenge. Es entsteht beim Lösen keine neue Substanz. Durch Eindampfen (und Auffangen des Wasserdampfes) kann man dieses Gemenge wieder in seine Bestandteile auftrennen. Die beiden Bestandteile Kochsalz und Wasser sind chemische Verbindungen. Durch chemische Vorgänge können sie in ihre jeweiligen Bestandteile zerlegt werden: das Wasser in zwei Gase, von denen eines brennbar ist, das andere nicht (Wasserstoff und Sauerstoff), das Salz in ein graues Metall und ein gelbgrünes Gas (Natrium und Chlor). Auch diese Stoffe bestehen ihrerseits aus noch kleineren Teilen, den Kernbausteinen Elektronen, Protonen und Neutronen.
Anderes Beispiel: Eisenspäne und Schwefelpulver gemischt ergeben ein Gemenge (Trennung z.B. mit Magnet). Wenn man es mit einem glühendem Draht berührt, glüht das Gemenge auf und es entsteht eine Verbindung: Eisensulfid. Eisensulfidmoleküle haben andere chemischen Eigenschaften als Eisen- oder Schwefelatome.
Für Elemente werden Symbole verwendet:
| H | lat.-gr. hydrogenium = Wasserbildner (weil Bestandteil des Wassers) | Wasserstoff |
| O | lat.-gr. oxygenium = Sauerbildner, gr. oxys: sauer, scharf | Sauerstoff |
| C | lat. carboneum = Kohlenstoff, lat. carbo: Kohle | Kohlenstoff |
| N | lat.-gr. nitrogenium = Salpeterbildner, gr. nitron: Natron, Soda | Stickstoff |
| S | lat. sulfur | Schwefel |
| Cl | gr. chloros: grün | Chlor |
| Fe | lat. ferrum | Eisen |
| Ag | lat. argentum | Silber |
| Au | lat. aurum | Gold |
| Pb | lat. plumbum | Blei |
| Hg | lat.-gr. hydrargyrum = Wassersilber (d.h. flüssiges Silber) | Quecksilber |
Für Verbindungen verwendet man Formeln:
| H2O | Wasser |
| H2SO4 | Schwefelsäre |
| CH4 | H | H–C–H | H |
Methan |
| C2H2 | H-C≡C-H | Azetylen |
Aus persönlichem Interesse habe ich eine etwas ausführlichere Darstellung zusammengestellt. In der Krankenpflegeschule habe ich mich auf das Bohrsche Atommodell beschränkt.
Das Massemodell beschreibt Atome als kleine, elastische, elektrisch neutrale, gleichmäßig mit Masse erfüllte Kugeln (Dalton-Modell). Dieses Modell kann bereits einige Eigenschaften von Atomen beschreiben (kinetische Gasgesetze, Massenverhältnisse u.a.). Unerklärt bleibt damit aber z.B. das Phänomen der Elekrizität.
Das Masse-Ladungs-Modell stellt Atome als gleichmäßig mit Masse und positiver Ladung ausgefüllte Kugeln dar, in die wie Rosinen in einem Kuchen negativ geladene Teilchen, die sog. Elektronen, eingebettet sind (Thomson-Modell). Damit lassen sich auch die Zusammenhänge zwischen Atomen und Elektrizität veranschaulichen.
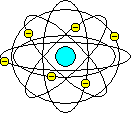
Der britische Physiker Ernest Rutherford (1871-1937, Nobelpreis f. Chemie 1908) schoß seit 1906 Alphateilchen auf eine Metallfolie und stellte zu seiner Überraschung fest, daß die Teilchen die Folie fast ungehindert durchdrangen, statt wie erwartet zum Großteil von der Folie reflektiert zu werden.
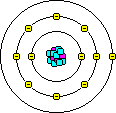
Rutherford zog daraus den Schluß, daß die Masse des Atoms in einem Punkt konzentriert ist, dessen Radius nur etwa 1/2000 des Atomradius beträgt. Er entwickelte das erste Kern-Hülle-Modell: es stellt Atome als Kugeln dar, die aus einem Kern und einer Hülle bestehen. Im Kern befindet sich die positive Ladung und fast die ganze Masse des Atoms. Um den Kern bewegen sich fast masselose, negativ geladene Elektronen, die die Hülle bilden (Rutherford-Modell). Die Elektronen müssen sich bewegen, weil sie sonst infolge der Anziehung in den Kern stürzen würden. Ein Atom ist also eine Art winziges Planetensystem mit dem Atomkern als Sonne und den Elektronen als Planeten.
Allerdings steht dieses Modell im Widerspruch zur klassischen Elektrodynamik, nach der die Elektronen laufend Energie abstrahlen und auf spiralförmigen Bahnen schließlich in den Kern stürzen müßten. Es erklärt auch nicht, warum der Bahnradius der Elektronen nicht beliebig ist, denn tatsächlich haben Atome immer ein ganz bestimmte Größe (die man seit Entdeckung der Avogadro-Konstanten auch berechnen konnte). Und nach diesem Modell müßte das Wasserstoffatom eine Scheibe sein.
Der deutsche Physiker Max Planck (1858-1947, Nobelpreis f. Physik 1918) erkannte um 1900, daß Lichtenergie nur in bestimmten Beträgen auftritt, nämlich in Vielfachen einer Konstanten h (und der Frequenz ν):
| E = h*ν | h = 6,63*10-34 Js (Plancksches Wirkungsquantum) |
Der dänische Physiker Niels Bohr (1885-1962, Nobelpreis f. Physik 1922) postulierte 1913, daß Elektronen sich nur auf solchen Bahnen bewegen können, bei denen das Produkt aus Impuls des Elektrons p (=m*v) und Umfang der Bahn (2rπ) ein ganzzahliges Vielfaches des Planckschen Wirkungsquantums h ist.
| 2rπ*mv = n*h | n = 1, 2, 3 usw. (Hauptquantenzahl) |
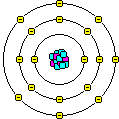
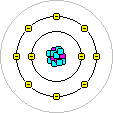
Das Bohrsche Atommodell besagt, daß sich Elektronen nur auf Bahnen mit bestimmten Radien um den Kern bewegen können. Die Atomhülle besteht also aus Elektronenschalen.
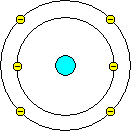
Der deutsche Physiker Arnold Sommerfeld (1868-1951) erweiterte das Bohrsche Modell dahingehend, daß sich Elektronen auch auf elliptischen Bahnen bewegen können. Für die Bestimmung der Ellipse wird neben der Hauptquantenzahl eine weitere Größe, die Nebenquantenzahl l (n-1, n-2, n-3 usw.) benötigt. Ein verbessertes Bohr-Sommerfeld-Modell benötigt zur Beschreibung des Energiezustands der Elektronen zwei weitere Größen: die Magnetquantenzahl m (±l, ±(l-1), ±(l-2) usw.) und die Spinquantenzahl s (±½).
Der aus Österreich stammende Physiker Wolfgang Pauli (1900-1958, Nobelpreis f. Physik 1945) formulierte 1924 das Pauliverbot (Paulisches Auschließungsprinzip), demzufolge in einem Atom keine zwei Elektronen in allen Quantenzahlen übereinstimmen dürfen. Daher ist die maximale Zahl der Elektronen pro Schale 2n2.
Der französische Physiker Louis Victor de Broglie
(sprich [broj], 1892-19??, Nobelpreis f. Physik 1929) verband 1924 die
Gleichungen von Einstein (E = mc2) und Planck (E = hν), sowie
die bekannte Beziehung zwischen Frequenz ν und Wellenlänge
λ (c = ν*λ ∀ ν = c/λ, c...
Ausbreitungsgeschwindigkeit der Welle):
mc2 = hν
hν = h(c/λ) ⇓
| λ = h/mc | oder kurz: | λ = h/p | (p... Impuls) |
Normalerweise schreibt man v (Vau) für die Geschwindigkeit (lat. velocitas). Um Verwechslungen mit ν (Ny) zu vermeiden, wurde hier c verwendet.
Er betrachtete das Elektron als stehende Welle um den Kern. Der Umfang der
Elektronenbahn muß dann ein ganzzahliges Vielfaches der Wellenlänge
sein (damit war eine physikalische Begründung für das bis dahin
unbewiesene Postulat Bohrs geliefert):
n*λ = 2rπ
n*(h/p) = 2rπ
nh = 2rπp
Der deutsche Physiker Werner Heisenberg (1901-1976, Nobelpreis f. Physik 1932) formulierte 1927 seine Unschärferelation, nach der es unmöglich ist, Ort und Impuls eines Teilchens gleichzeitig genau anzugeben. Der Aufenthaltsort eines Elektrons läßt sich nur mit einer gewissen Wahrscheinlichkeit angeben. Das Produkt der Unschärfen der Messung von Ort und Impuls kann eine gewisse Konstante nicht unterschreiten.
| ΔxΔpx ≥ h/2π | h/2π = h̄ = 1,0546*10-34 Js |
Daraus folgt nun, daß ein Teilchen, das auf einen bestimmten
Aufenthaltsbereich eingeschränkt ist, immer eine gewisse Bewegungsenergie
hat, der Impuls kann nicht 0 sein. Da das Elektron im Atom auf eine Entfernung
r (Atomradius) vom Atomkern eingeschränkt ist, ist sein
stationärer Zustand ein Bewegungszustand, in dem das Elektron ohne
Energieverlust verharren kann.
Δr = r
Δr*Δp = h/2π ∀
rp = h/2π ⇓
p = h/2πr
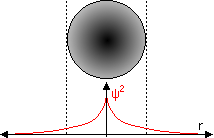
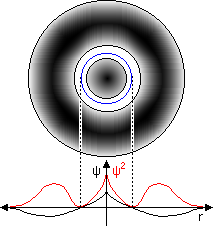
Der österreichische Physiker Erwin Schrödinger (1887-1961, Nobelpreis f. Physik 1933) stellte 1926 eine nach ihm benannte Differentialgleichung für die einem Elektron zugeordneten Welle (de Brogli-Welle, Wahrscheinlichkeitswelle) auf. Das Amplitudenquadrat ψ2 dieser Welle bezeichnet die Wahrscheinlichkeitsdichte (die Antreffwahrscheinlichkeit in einem Volumselement). Ihre grafische Darstellung sind die sog. Orbitale. Nach der Form der von der Nebenquantenzahl abhängigen Wellenknoten unterscheidet man s- (sphärische Knotenfläche), p- (planare), d- (diffuse) und f-Orbitale. Die maximale Besetzung mit Elektronen beträgt s: 2, p: 6, d: 10, f: 14.
 |
 |
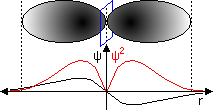 |
| 1s-Orbital: der Wahrscheinlichkeitsdichteraum ist eine Kugel. | 2s-Orbital: die Wahrscheinlichkeitswelle hat eine Oberschwingung, die Knotenfläche (blau) ist eine Kugel; der Wahrscheinlichkeitsdichteraum ist eine Kugel in einer Hohlkugel. | 2p-Orbital: die Wahrscheinlichkeitswelle hat eine Oberschwingung, ist aber antisymmetrisch, die Knotenfläche ist eine Ebene; der Wahrscheinlichkeitsdichteraum ist leicht eiförmig. |
Da Atome elektrisch neutral sind, müssen den negativ geladenen Elektronen in der Atomhülle positiv geladene Ladungsträger im Atomkern entsprechen, die sog. Protonen.
Mit der Entwicklung der Massenspektrographen wurde es möglich, die Massen einzelner Atome zu bestimmen. Dabei entdeckte man, daß es neben dem „normalen“ Wasserstoff auch schwere Wasserstoffatome gibt, die ziemlich genau die doppelte Masse haben.
Da auch der schwere Wasserstoff nach außen elektrisch neutral ist, lag es nahe, anzunehmen, daß dieser im Kern ein weiteres Proton und Elektron hat. Aber nach der Quantenmechanik ist es praktisch unmöglich, daß ein Elektron dauernd im Kern verweilt. Die zusätzliche Masse muß also von einem elektrisch neutralen Teilchen stammen, das fast die gleiche Masse hat wie das Proton, dem Neutron.
Erst 1930 gelang beim Beschuß von Beryllium mit Alphateilchen der experimentelle Nachweis der Neutronen: das so beschossene Beryllium sendet eine Strahlung aus, die auch Bleiplatten durchdringt (die ausgesendeten Teilchen müssen also kleiner sein als Alphateilchen) und fast keine ionisierende Wirkung hat (also keine elektrische Ladung trägt).
Ein Atom besteht aus:
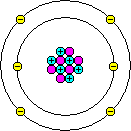
Man schreibt dafür:
|
links oben: Atomgewicht = Summe der Kernbausteine (Σ n+p) links unten: Ordnungszahl = Anzahl der p+ (↓ Anzahl der Neutronen = Atomgewicht - Ordnungszahl) rechts oben: Zahl und Art der elektrischen Ladungen nach außen (hier leer, weil elektrisch neutral) |
Die Zahl der Protonen heißt Ordnungszahl oder Kernladungszahl. Sie bestimmt, um welches Element es sich handelt. Im elektrisch neutralen Atom ist die Zahl der Elektronen gleich der Zahl der Protonen.
Atome gleicher Ordnungszahl mit unterschiedlicher Neutronenzahl heißen Isotope. Beispiele:
| Sym. | Bezeichnung | Atomkern besteht aus |
|---|---|---|
| 11H | Wasserstoff | einem Proton |
| 12H, D | schwerer Wasserstoff, Deuterium | einem Proton und einem Neutron |
| 13H, T | Tritium | einem Proton und zwei Neutronen |
| 612C | „normaler“ Kohlenstoff | 6 Protonen und 6 Neutronen |
| 614C | sog. C14 | 6 Protonen und 8 Neutronen |
Wenn die Zahl der Protonen und Elektronen nicht gleich ist, sind die Atome bzw. Moleküle elektrisch geladen, man spricht von Ionen. Schreibweise und Benennung:
| Art | elektrische Ladung |
wandern im elektr. Feld zur |
Beispiele | |
|---|---|---|---|---|
| Kationen | positiv | Kathode | Na+ Natriumplus, Natriumion Ca2+ Calciumzweiplus, Calziumion |
|
| Anionen | negativ | Anode | einfache | Cl- Chlorminus, Chlorion, in Verbindungen: Chlorid Br- Bromid, I- Jodid, Fl- Fluorid S2- Sulfid, O2- Oxid, OH- Hydroxid, CH- Cyanid |
| Oxokomplexe | SO42- Sulfat, CO32- Carbonat, NO2- Nitrat, ClO3- Chlorat, ClO4- Perchlorat | |||
Wenn man die Elemente nach steigender Ordnungszahl ordnet, ergibt sich das Periodensystem der Elemente.
Waagrecht Perioden, senkrecht Gruppen.
| Ordnungszahl chem. Symbol Elementname (lat. Name) Orbitalkonfiguration mittlere Atommasse |
Die Atommasse (früher Atomgewicht genannt), wurde so definiert, daß dem Isotop 12C die Masse 12u zugeordnet wurde. Bei der mittleren Atommasse sind auch die natürlich vorkommenden Isotope und ihre relative Häufigkeit berücksichtigt.
| I | II | III | IV | V | VI | VII | VIII | ||
|---|---|---|---|---|---|---|---|---|---|
| Alkali- metalle |
Erdalkali- metalle |
Erd- metalle |
Kohlenstoff- gruppe |
Stickstoff- gruppe |
Chalkogene | Halogene | Edelgase | ||
| 1 1s |
1 H Wasserstoff (Hydrogenium) 1 1,0079 |
2 He Helium 24,0026 |
|||||||
| 2 2s 2p |
3 Li Lithium 1 0 6,94 |
4 Be Beryllium 2 0 9,01218 |
5 B Bor 2 1 10,81 |
6 C Kohlenstoff (Carboneum) 2 2 12,011 |
7 N Stickstoff (Nitrogenium) 2 3 14,0067 |
8 O Sauerstoff (Oxygenium) 2 4 15,9994 |
9 F Fluor 2 5 18,9984 |
10 Ne Neon 2 6 20,179 |
|
| 3 3s 3p |
11 Na Natrium 1 0 39,0983 |
12 Mg Magnesium 2 0 24,305 |
13 Al Aluminium 2 1 26,98154 |
14 Si Silicium 2 2 28,0855 |
15 P Phosphor 2 3 30,97376 |
16 S Schwefel (Sulfur) 2 4 32,06 |
17 Cl Chlor 2 5 35,453 |
18 Ar Argon 2 6 39,948 |
|
| 4 3d 4s 4p |
19 K Kalium 0 1 0 39,0983 |
20 Ca Calcium 0 2 0 40,08 |
21 Sc - 30 Zn | 31 Ga Gallium 10 2 1 69,72 |
32 Ge Germanium 10 2 2 72,59 |
33 As Arsen 10 2 3 74,9216 |
34 Se Selen 10 2 4 78,96 |
35 Br Brom 10 2 5 79,904 |
36 Kr Krypton 10 2 6 83,8 |
| 5 4d 5s 5p |
37 Rb Rubidium 0 1 0 85,4678 |
38 Sr Strontium 0 2 0 87,62 |
39 Y - 48 Cd | 49 In Indium 10 2 1 114,82 |
50 Sn Zinn (Stannum) 10 2 2 118,69 |
51 Sb Antimon (Stibium) 10 2 3 121,75 |
52 Te Tellur 10 2 4 127,6 |
53 I Iod 10 2 5 126,9045 |
54 Xe Xenon 10 2 6 131,3 |
| 6 5d 6s 6p |
55 Cs Caesium 0 1 0 132,9054 |
56 Ba Barium 0 2 0 137,33 |
57 La - 80 Hg | 81 Tl Thallium 10 2 1 204,37 |
82 Pb Blei (Plumbum) 10 2 2 207,2 |
83 Bi Wismut (Bismutum) 10 2 3 208,9808 |
84 Po Polonium 10 2 4 (209) |
85 At Astat 10 2 5 (210) |
86 Rn Radon 10 2 6 (222) |
| 7 6d 7s |
87 Fr Francium 0 1 (223) |
88 Ra Radium 0 2 226,0254 |
89 Ac - 112 Uub | 113 Uut Ununtrium |
114 Uuq Ununquadium |
115 Uup Ununpentium |
116 Uuh Ununhexium |
117 Uus Ununseptium |
118 Uuo Ununoctium |
| III | IV | V | VI | VII | VIII | I | II | ||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| 4 3d 4s |
21 Sc Scandium 1 2 44,9559 |
22 Ti Titan 2 2 47,90 |
23 V Vanadium 3 2 50,9415 |
24 Cr Chrom 5 1 51,996 |
25 Mn Mangan 5 2 54,938 |
26 Fe Eisen (Ferrum) 6 2 55,847 |
27 Co Cobalt 7 2 58,9332 |
28 Ni Nickel 8 2 58,71 |
29 Cu Kupfer (Cuprum) 10 1 63,55 |
30 Zn Zink 10 2 65,38 |
|
| 5 4d 5s |
39 Y Yttrium 1 2 88,9059 |
40 Zr Zirkonium 2 2 91,22 |
41 Nb Niob 4 1 92,9064 |
42 Mo Molybdän 5 1 95,94 |
43 Tc Technetium 6 1 (97) |
44 Ru Ruthenium 7 1 101,07 |
45 Rh Rhodium 8 1 102,9055 |
46 Pd Palladium 10 0 106,4 |
47 Ag Silber (Argentum) 10 1 107,686 |
48 Cd Cadmium 10 2 112,41 |
|
| 6 5d 6s |
57 La Lanthan 1 2 138,9055 |
58 Ce - 71 Lu Lanthanoide |
72 Hf Hafnium 2 2 178,49 |
73 Ta Tantal 3 2 180,9479 |
74 W Wolfram 4 2 183,85 |
75 Re Rhenium 5 2 186,2 |
76 Os Osmium 6 2 190,2 |
77 Ir Iridium 7 2 192,22 |
78 Pt Platin 9 1 195,09 |
79 Au Gold (Aurum) 10 1 196,9665 |
80 Hg Quecksilber (Hydrargyrum) 10 2 200,59 |
| 7 6d 7s |
89 Ac Actinium 1 2 (227) |
90 Th - 103 Lr Actinoide |
104 Rf Rutherfordium (Ku Kurtschatovium) (261) |
105 Db Dubnium (Ha Hahnium) (262) |
106 Sg Seaborgium (263) |
107 Bh Bohrium |
108 Hs Hassium |
109 Mt Meitnerium |
110 Ds Darmstadtium |
111 Rg Roentgenium |
112 Uub Ununbium |
| 6 4f 5d 6s |
58 Ce Cer 2 0 2 140,12 |
59 Pr Praseodym 3 0 2 140,907 |
60 Nd Neodym 4 0 2 144,24 |
61 Pm Promethium 5 0 2 (145) |
62 Sm Samarium 6 0 2 150,4 |
63 Eu Europium 7 0 2 151,96 |
64 Gd Gadolinium 7 1 2 157,25 |
65 Tb Terbium 9 0 2 158,9254 |
66 Dy Dysprosium 10 0 2 162,5 |
67 Ho Holmium 11 0 2 164,9304 |
68 Er Erbium 12 0 2 167,26 |
69 Tm Thulium 13 0 2 168,9342 |
70 Yb Ytterbium 14 0 2 173,04 |
71 Lu Lutetium 14 1 2 174,967 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 7 5f 6d 7s |
90 Th Thorium 0 2 2 232,0381 |
91 Pa Protactinium 1 2 2 231,0359 |
92 U Uran 3 1 2 238,029 |
93 Np Neptunium 4 1 2 237,0482 |
94 Pu Plutonium 5 1 2 (244) |
95 Am Americium 6 1 2 (243) |
96 Cm Curium 7 1 2 (247) |
97 Bk Berkelium 8 1 2 (247) |
98 Cf Californium 9 1 2 (251) |
99 Es Einsteinium 10 1 2 (254) |
100 Fm Fermium 11 1 2 (257) |
101 Md Mendelevium 12 1 2 (258) |
102 No Nobelium 13 1 2 (259) |
103 Lr Lawrencium 14 1 2 (260) |
Die Elemente von Am (95) an kommen in der Natur nicht vor, sondern werden in Teilchenbeschleunigern künstlich erzeugt. Als ich maturiert habe (1980), war das letzte nachgewiesene Element das mit der Ordnungszahl 105 (es hieß damals Hahnium). Laut Chemiebuch meiner Tochter (2003) sind inzwischen die Elemente bis 114 nachgewiesen (ausgenommen das 113er). Das Hahnium heißt darin Dubnium. Die Namen der Elemente ab 110 (Unun*ium) sind wohl nur vorläufige Arbeitsnamen.
Zu den englischen Bezeichnungen sei folgendes vermerkt:
Auch an der Größe der Atome kann man die Periodisierung gut ablesen. Innerhalb einer Periode haben die Alkalimetalle den größten Atomdurchmesser. Mit zunehmender Elektronenzahl nimmt infolge der steigenden Anziehungskraft der Atomdurchmesser ab, bis er bei den Edelgasen seine geringste Größe erreicht. Die Entfernung eines Elektrons führt bei den Alkalimetallen zu einer drastischen Verringerung des Atomradius.
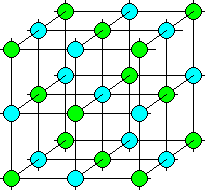
Metalle haben meist 1 oder 2 Außenelektronen. Sie bilden Gitter, in denen die Metallatome so viele Außenelektronen abgegeben haben, daß eine stabile Edelgaskonfiguration entsteht. Diese Atome sind also positiv geladene Ionen. Die abgegebenen Elektronen bewegen sich zwischen den Metallionen hin und her und bilden ein sog. „Elektronengas“. Daher sind Metalle gute Leiter.
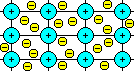
In Salzen gibt ein Metallatom Elektronen an ein Nichtmetallatom ab. Ersteres wird dadurch positiv, letzteres negativ geladen. Durch die gegenseitige Anziehung und Abstoßung kommt es zur Bildung von Kristallgittern. Löst man diese Kristalle in Wasser, entstehen elektrisch leitende Lösungen.
 + + |
 ↓ ↓ |
 + + |
 |
 |
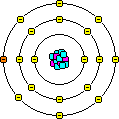
| 11 p+, 11 e- | 17 p+, 17 e- | 11 p+, 10 e- | 17 p+, 18 e- | |
| Na· | : |
Na+ | [: |
Um die Verhätnisse in der äußersten Elektronenschale zu verdeutlichen, schreibt man die Anzahl der Außenelektronen in Form von Punkten um das chemische Symbol. Statt zwei Punkten kann man auch einen Strich (=Elektronenpaar) machen.
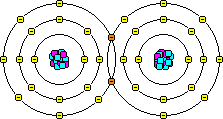
Nichtmetallatome können ihre Außenalektronen nur schwer ablösen. Sie bilden stattdessen mit anderen Atomen gemeinsame Elektronenpaare. Da es keine freien Elektronen gibt, sind Stoffe mit Elektronenpaarbindung Nichtleiter oder Isolatoren.
 + + |
 ↓ ↓ |
 |
:![]() · +
·
· +
·![]() : ↓
:
: ↓
:![]() :
:![]() :,
|
:,
|![]() -
-![]() |,
Cl2
|,
Cl2
H· + H· ↓ H:H, H-H, H2 (alle gasförmigen Element mit Ausnahme der Edelgase bestehen aus zweiatomigen Molekülen)
|![]() +
+
![]() | ↓
| ↓
![]() =
=![]() ↵ ·
↵ ·![]() -
-![]() ·
·
|C| + O2 ↓
![]() =C=
=C=![]() ↵ |O≡C-
↵ |O≡C-![]() |, CO2
|, CO2
Es entstehen stabile „Achterschalen“ in den Außenschalen, wie sie von den Edelgasen her bekannt sind (bei H2 natürlich nur eine Zweierschale). Man kann den Atomen in einem Molekül ein Elektronenoktett in der Außenschale zuordnen.
Wie man an den Beispielen oben sieht, sind auch Mehrfachbindungen
möglich: Doppelbindung ~ zwei gemeinsame Elektronenpaare, Dreifachbindung
~ drei gemeinsame Elektronenpaare:
·![]() +
+
![]() · ↓
|N≡N|, N2
· ↓
|N≡N|, N2
Ein Spezialfall ist die koordinative oder
dative Bindung (symbolisiert durch einen Pfeil
↓): ein Atom stellt beide Elektronen des gemeinsamen Elektronenpaares
zur Verfügung, das andere verfügt über den freien Platz:
H-![]() -
-![]() ↓
↓![]() |
(Chlorige Säure)
|
(Chlorige Säure)
Schwache chemische Bindung zwischen einem H-Atom, das an ein elektronegatives
Atom gebunden ist, und einem weiteren elektronegativen Atom:
-H···O, -H···N, -H···S,
-H···Halogen
Dies führt zur Bildung von Molekülassoziationen, wodurch die Schmelz- und Siedepunkte der betreffenden Verbindungen deutlich erhöht werden, z.B. bei Wasser:
H-O-H H-O-H
\ / \
H-O-H H-O-H
Auch der Zusammenhalt der Peptidketten der Eiweiße und der Einzelstränge der DNS beruhen auf Wasserstoffbrückenbindung der Form N-H···O.
Die Valenz ist jene Zahl, die besagt, wieviele H-Atome ein Atom oder eine Atomgruppe binden oder ersetzen kann. Anders gesagt: Valenz ist die Zahl der Elektronen, die ein Atom abgeben oder aufnehmen kann. (Sie korreliert daher mit der Zahl der Außenelektronen, ist aber nicht mit ihr identisch.)
| I | H, Na, K, Ag; OH, NO3; Cl, I, Cu |
| II | O, Ca, Mg, Hg, Zn, Mn; CO3, SO3, SO4: Cu, Fe, S |
| III | N, B, Al; Fe |
| IV | C, Si; S |
| V | Cl, I |
| VI | S |
| VII | Cl, I |
Nicht bei allen Moleküen sind sämtliche Wertigkeiten abgesättigt: C (IV) bindet zwei O (II), also CO2. Im Kohlenmonoxid CO ist also eine Valenz von II ungebunden. Solche Moleküle haben die Neigung, in einfachere Verbindungen zu zerfallen oder durch Angliederung anderer Atome / Moleküle die noch freien Wertigkeiten zu binden.
Viele Element können in mehreren Wertigkeiten auftreten. Als Beispiele seien S (II, IV, VI) und Fe (II, III) angeführt.
| II | H2S | Schwefelwasserstoff | H-S-H | S nimmt zwei Elektronen auf. |
| IV | SO2 | Schwefeldioxid, Schwefel(IV)oxid | O↑S=O | koordinative Bindung |
| VI | SO3 | Schwefel(VI)oxid |
O O
→ →
O=S + H2O ↓ H-O-S-O-H
↔ ↔
0 O
|
S gibt seine sechs Außenelektronen ab. |
| II | FeCl2 | Eisen(II)chlorid | Fe2+ 2Cl- | Fe hat die zwei Außenelektronen seiner vierten Schale an zwei Cl abgegeben. |
| III | FeCl3 | Eisen(III)chlorid | Fe3+ 3Cl- | Fe hat zusätzlich noch ein Elektron aus seiner dritten Schale an ein weiteres Cl abgegeben. |
| 2Mg + 02 ↓ 2MgO Magnesiumoxid Mg| + (Ist Magnesiumoxid wirklich eine Ionenverbindung?) |
Mg + Cl2 ↓ MgCl2 Magnesiumchlorid Mg| + 2 · |
Den Vorgang der Abgabe von Elekronen nennt man Oxidation, den der Elektronenaufnahme Reduktion (Mg wurde oxidiert, O2 und Cl2 reduziert). Der Reaktionspartner, der Elektronen abgibt, ist das Reduktionsmittel, er wird oxidiert. Der Reaktionspartner, der Elektronen aufnimmt, ist das Oxidationsmittel, er wird reduziert. Der Vorgang der Oxidation des einen und Reduktion des anderen Reaktionspartners heiß Redoxreaktion. (Andere Definition: Disproportionierung, Komproportionierung).
Zn2+-Ionen wandern zum negativen Pol (Kathode), erhalten dort jeweils zwei e- und werden entladen. Die I--Ionen wandern zum positiven Pol (Anode), geben dort jeweils ein e- ab und werden so entladen.
| Zn2+ + 2e- ↓ Zn | Elektronenaufnahme = Reduktion |
| 2I- ↓ I2 + 2e- | Elektronenabgabe = Oxidation |
| Zn2+ + 2I- ↓ Zn + I2 | Redoxreaktion |
Aluminiumgewinnung aus reiner Aluminiumoxidschmelze (sog. Schmelzelektrolyse,
erfordert hohe Stromstärken):
2Al3+ + 3O2- ↓ 2Al + 3O (1½ O2)
Wenn bei der Reaktion Fe + S ↓ FeS nicht ungenutzte Fe- oder S-Atome überbleiben sollen, muß man gleichviel Fe- wie S-Atome verwenden. 1 g Fe enthält nun aber viel weniger Atome als 1 g S (weil Fe-Atome größer und schwerer sind).
1 mol = Atomgewicht (bei Molekülen Summe der Atomgewichte) in g. 1 mol eines beliebigen Stoffes enthält immer 6,023 * 1023 Teilchen (Loschmidtsche Zahl, Avogadro-Konstante). 1 mol eines beliebigen Gases hat unter Normalbedingungen immer ein Volumen von 22,4 dm3.
1 mol Fe ~ 56 g, 1 mol S ~ 32 g; d.h. man muß Eisen und Schwefel im Verhältnis 56:32 (gekürzt 7:4) verwenden.
Wieviel gebrannten Kalk liefert eine Tonne Kalkstein?
CaCO3 ↓ CaO + CO2
Aus 1 mol Kalk gewinnt man 1 mol gebrannten Kalk.
1 mol Kalk = 40 + 12 + 3*16 = 100g
1 t = 1.000.000 g = 10.000 mol Kalk
1 mol gebrannter Kalk = 40 + 16 = 56 g
10.000 * 56 = 560.000 g = 560 kg
Wieviel Luft braucht man zur Verbrennung von 1 kg Kohlenstoff?
C + O2 ↓ CO2
1 mol C = 12 g
1 kg C enthät also 1000/12 = 83,3 mol
1 mol O2 hat ein Volumen von 83,3 * 22,4 = 1866,6 dm3
bei 20,8% Anteil an der Luft sind das ~ 8974 l Luft (etwas mehr als
2 m3)
(Stimmt das wirklich?)
Wieviel FeS braucht man, um nach der Reaktion FeS + 2HCl ↓ H2S +
FeCl2 1 l H2S zu gewinnen?
1 l eines Gases sind 1/22,4 ~ 0,044643 mol
1 mol FeS = 56 + 32 = 88 g
0,045 mol FeS = 3,93 g
Das Eigenschaftswort zu Säure ist sauer. Basen werden auch Laugen genannt, das Eigenschaftswort dazu ist basisch oder alkalisch.
Säuren zerfallen in wässriger Lösung in H+-Ionen und Säurerestionen, Basen spalten OH-- (Hydroxid-)Ionen ab. Man spricht von elektrolytischer Dissoziation.
| H2SO4 | ↓ | 2H+ + | SO42- |
| Schwefelsäure | Sulfation | ||
| NaOH | ↓ | Na+ | OH- |
| Natriumhydroxid | Hydroxidion |
Säuren sind Substanzen, die H+ abgeben, Basen Substanzen, die H+ aufnehmen. Da H+ ein Wasserstoffatom ohne sein Elektron ist, also ein Wasserstoffkern, der ja nur aus einem Proton besteht, sagt man: Säuren sind protonenabgebende Substanzen (Protonendonatoren), Basen protonenaufnehmende (Protonenakzeptoren).
| H2SO4 | + 2H2O ↓ | 2H3O+ + | SO42- |
| Schwefelsäure | Hydroniumion | Sulfation | |
| HCl | + 2H2O ↓ | H3O+ + | Cl- |
| Chlorwasserstoff | Chloridion |
Die Abtrennung von Protonen durch Lösungsmittel heißt Säureprotolyse. Ist Wasser das Lösungsmittel, spricht man von Hydrolyse.
| NH3 | + H2O ↓ | NH4+ + | OH- |
| Ammoniak | Ammoniumion | Hydroxidion |
Daher leiten wässrige Lösungen von Säuren und Basen den elektrischen Strom. In Säuren sind die Atome kovalent verbunden. Durch Abgabe von H+ entstehen Ionen (H3O+ [Hydronium], Säurerestionen). Bei Basen liegt in den Metallhydroxiden, deren wässrige Lösung die Basen darstellen (NaOH, KOH, Ca(OH)2, Ba(OH)2) bereits Ionenverbindung vor.
Säuren sind Substanzen, die ein Elektronenpaar aufnehmen, (Elektronenpaarakzeptoren), Basen Substanzen, die ein Elektronenpaar abgeben (Elektronenpaardonatoren). Der Unterschied zu Brønsted: Nach Brønsted müssen Säuren immer Wasserstoff enthalten, weil sie ja H+ abgeben, nach Lewis können auch solche Stoffe Säuren sein, die Brønsted-Basen neutralisieren, ohne Wasserstoff zu enthalten.
| SO2 + | H2O | ↓ H2SO3 |
| Lewis-Säure | Lewis-Base |
Auch Lösungen von Metalloxiden reagieren alkalisch:
| CaO + | H2O | ↓ Ca2+ + 2OH- [= Ca(OH)2] |
| Lewis-Base |
Calciumoxid hat hier im Gegensatz zur Definiton von Brønsted kein Proton aufgenommen, sondern zwei Elektronen abgegeben.
Die gegenseitige Aufhebung von saurer bzw. basischer Eigenschaft heißt
Neutralisation. Hydroniumion und Hydroxidion
verbinden sich zu Wasser, Säure- und Basenrest zu einem Salz:
NaOH + HCl ↓ 2H2O + NaCl
| Na+OH- + H3O+Cl- |
↓ | 2H2O + Na+Cl- |
Allgemeiner: H[S] + [B]OH ↓ 2H2O + [B][S]
pH steht für potentia Hydrogenii (Kraft / Mächtigkeit des Wasserstoffs, nach der Säuredefinition von Arrhenius).
2H2O ↓ H3O+ + OH- = Autoprotolyse des Wassers. Bei 22°C befinden sich in 1 l Wasser 1/10.000.000 (10-7) Mol H3O+-Ionen und ebensoviel OH--Ionen (in g: 19*10-7 ~ 1,9µg H3O+, 17*10-7 ~ 1,7µg OH-). Das Produkt der beiden Ionenkonzentrationen beträgt 10-7* 10-7 = 10-14 = 1/1014.
Der pH-Wert ist der negative dekadische Logarithmus der H3O+-Konzentration (in Mol/l bei 22°C). Anders gesagt, er ist der Exponent unter Weglassung des Vorzeichens. 10-7 ↓ pH-Wert 7.
Wenn die H3O+-Konzentration steigt, sinkt der pH-Wert und umgekehrt. Das Produkt der Ionenkonzentrationen beträgt immer 10-14 (pH + pOH = 14).
Viele chemische Reaktionen laufen abhängig vom pH-Wert ab. Die Eiweißverdauung im Magen bei pH 2. Blut hat eine pH von 7,4.
Ein Indikator ist eine Substanz, die anzeigt, ob ein Stoff sauer bzw. basisch ist.
| Säure | Base | |
|---|---|---|
| Lackmus | rot | blau |
| Phenolphthalein | farblos | rot |
| Methylorange | gelb | rot |
Sehr schwere Atomkerne senden 24He(2+)-Kerne
aus, die Alphastrahlung:
92238U ↓ 90234Th
(Thorium) + 24He
90234Th ↓ 88230Ra
(Radium) + 24He
88230Ra ↓ 86226Rn
(Radon) + 24He usw.
Alphastrahlung ist wenig durchdringend, hat eine Luftweitreiche von max. 30 cm, kann durch Papier abgeschirmt werden, ist inkoporiert aber sehr zerstörend.
Umwandlung schwach neutronenschwerer Kerne: 01n ↓
11p + e- + ν̄ (Antineutrino, sehr geringe
Wechselwirkung):
13H (Tritium) ↓ 23He +
e-
1940K ↓ 2040Ca +
e- (stabil ist 1939K)
Betastrahlung ist durchdringender als Alphastrahlung, wird von dünnen Al-Schichten zurückgehalten, verursacht Verbrennungen.
Es gibt auch einen β+-Zerfall (Positronenstrahlung): 11p ↓ 01n + e+ (Positron) + ν (Neutrino).
Sehr kurzwellige Röntgenstrahlung, die von Atomkernen ausgesandt wird, wenn diese aus einem energetisch angeregten Zustand in den energetischen Grundzustand zurückkehren. Durchdringt auch dicke Betonabschirmungen. Gammastrahlung sind keine Teilchen, sondern elektromagnetische Strahlung.
Nur bei superschweren Elementen:
98256Cf (Californium) ↓ 98251Cf
+ 5 01n
Halbwertszeit ist die Zeit, in der die Hälfte der Atome eines radioaktiven Stoffes zerfällt. Nach 2 Halbwertszeiten ist noch ein Viertel der Ausgangsmenge übrig, nach 3 Halbwertszeiten ein Achtel usw. Nt = N0 * 10-0,3*t/t½ (t ist die vergangene Zeit, Nt ist die Menge nach dieser vergangenen Zeit, N0 ist die Menge zum Ausgangszeitpunkt).
Verschiedene Halbwertszeiten:
238U: 4,51 * 109 a (4 Mia 510 Mio Jahre)
24Na: 15 h
14C: 5770 a
Wie lange dauert es, bis ein durch 90Sr (Strontium, t½ = 28 a) verseuchtes Gebiet betretbar ist, d.h. bis die Restaktivität 1 Millionstel (10-6) der Anfangsaktivität beträgt?
| Nt = N0 * 10-6 | |
| N0 * 10-6 = N0 * 10-0,3t/28 a | | :N0 | log x |
| -6 = -0,3t/28 a | | *(-28 a) |
| 6 * 28 a = 0,3t | | : 0,3 |
| t = 6 * 28 a / 0,3 = 560 a |
Wieviel 18F (t½ = 1,87 h) muß man bei 12,5 h Transportzeit bestellen, um bei Ankunft 1 mg zur Verfügung zu haben?
| Nt = 1 mg | |
| 1 mg = N0 * 100,3*12,5 h/1,87 h = N0 * 10-2,005 ~ N0 * 10-2 | |
| 1 = N0 * 10-2 | | :10-2 |
| N0 = 1/10-2 = 102 = 100 mg |
leichtestes Element, farb- und geruchloses, brennbares Gas (verbrennt zu Wasser, daher der Name)
häufigstes Element der oberen Erdrinde (46,6%), in der Luft 20,8 Vol% (23 Gew%); farb- und geruchloses, unbrennbares Gas, zur Verbrennung notwendig (Nachweis: glimmender Holzspan).
farb- und geruchloses Gas, ca. 70% d. Luft sind Stickstoff, äußerst träg, in Eiweiß enthalten.
H-N=N=N ↵ H-N-N≡N)3 Modifikationen: rhombische Kristalle (α-S, bei Kristallisieren aus Lösungen), Nadeln (β-S, bei Abkühlen von Schmelzen), amorphe plastische elastische Masse (γ-S, bei Abschrecken von Schmelzen), je nachdem ob S8-Ringmoleküle, S6- u. S4-Kettenmoleküle; in vielen Mineralen, organisch in Eiweiß, Haaren.
3 Modifikationen: Diamant (Atomgitter, sehr hart, stark lichtbrechend, Nichtleiter), Graphit (ebene, gegeneinander verschiebbare Schichtgitter, daher Schmiermittel, Stromleiter ↓ Graphitelektroden; Bleistiftminen; in Atomreaktoren), Ruß (verfilzte Graphitkriställchen); Koks, Kohle als Brennstoffe enthalten überwiegend Kohlenwasserstoffe (↓ organ. Chemie).
grüngelbes, schweres, stechend riechendes, sehr giftiges Gas; reagiert mit fast allen Metallen ↓ Chlorid:
IV-wertiges Halbmetall, glänzende, dunkelbraune Kristalle, Nichtleiter, durch gezielte Verunreinigung (Dotierung) wichtigster Halbleiter (Computerchips)
OH OH
| |
HO-Si-O-Si-...-OH
| |
OH OHd. H | H-C-O-H | H
-C=O \ O-
Autor:
(E-Mail-Kontakt)
Letzte Änderung: 30. Jan. 2025